1.Powers AC, Fowler MJ, Rickels MRDiabetes mellitus: management and therapies. In: Loscalzo J, Fauci A, Kasper D, Hauser S, Longo D, Jameson JL, eds. Harrison's principles of internal medicine. 21st ed.New York, NY: McGraw Hill; 2022.
2.Di Angelantonio E, Gao P, Khan H, Butterworth AS, Wormser D, Kaptoge S, et al. Glycated hemoglobin mea-surement and prediction of cardiovascular disease. JAMA 2014;311:1225-33.


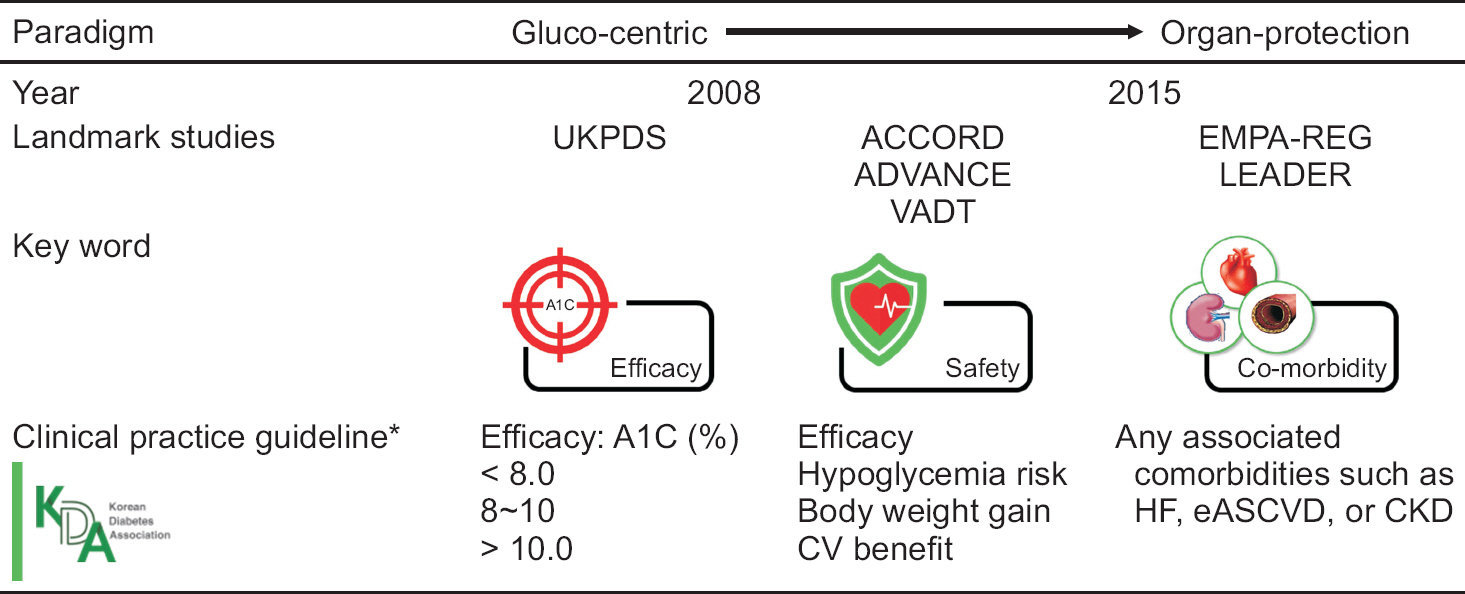
3.UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998 352:837-53. Erratum in: Lancet 1999;354: 602.


4.Stratton IM, Adler AI, Neil HA, Matthews DR, Manley SE, Cull CA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000;321:405-12.

5.Pirart J. Diabetes mellitus and its degenerative complications: a prospective study of 4,400 patients observed between 1947 and 1973. Diabetes Care 1978;1:252-63.

6.World Health Organization (WHO)Use of glycated hae-moglobin (HbA1c) in diagnosis of diabetes mellitus: ab-breviated report of a WHO consultation. Geneva: WHO; 2011.
8.Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-Year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008;359:1577-89.


11.Gaede P, Lund-Andersen H, Parving HH, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008;358:580-91.


14.Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-72.


15.Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD, et al; VADT Investigators. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360:129-39.


16.Currie CJ, Peters JR, Tynan A, Evans M, Heine RJ, Bracco OL, et al. Survival as a function of HbA(1c) in people with type 2 diabetes: a retrospective cohort study. Lancet 2010;375:481-9.


18.U. S. Food and Drug AdministrationGuidance for indus-try on diabetes mellitus-evaluating cardiovascular risk in new anti-diabetic therapies to treat type 2 diabetes. Silver Spring, MD: U. S. Food and Drug Administration; 2008.
20.Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, et al; SAVOR-TIMI 53 Steering Committee and Investigators. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369:1317-26.


21.Scheen AJ. Cardiovascular effects of new oral glucose-low-ering agents: DPP-4 and SGLT-2 inhibitors. Circ Res 2018;122:1439-59.


22.Sano M. Mechanism by which dipeptidyl peptidase-4 inhibitors increase the risk of heart failure and possible differences in heart failure risk. J Cardiol 2019;73:28-32.


25.Vaduganathan M, Januzzi JL Jr. Preventing and treating heart failure with sodium-glucose co-transporter 2 inhibitors. Am J Med 2019;132(10 Suppl):S21-9.

27.Heerspink HJL, Stef├Īnsson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF, et al; DAPA-CKD Trial Com-mittees and Investigators. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383:1436-46.


28.Ryan DH, Lingvay I, Colhoun HM, Deanfield J, Emerson SS, Kahn SE, et al. Semaglutide effects on cardiovascular outcomes in people with overweight or obesity (SELECT) rationale and design. Am Heart J 2020;229:61-9.


30.Kibble JD, Halsey CRMedical physiology: the big picture. New York, NY: McGraw Hill; 2014. Notice.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print